Щелочные металлы
Щелочные металлы.
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Далее таблица свойств щелочных металлов:
|
Атомный номер |
Название, символ |
Металлический радиус, нм |
Ионный радиус, нм |
Потенциал ионизации, эВ |
ЭО |
p, г/см³ |
tпл, °C |
tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
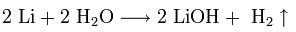
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
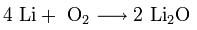
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:

В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
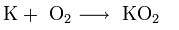
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
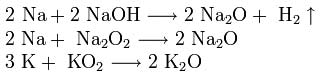
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
|
Формула кислородного соединения |
Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 |
Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 |
Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
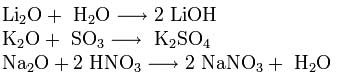
Пероксиды и надпероксиды проявляют свойства сильных окислителей:

Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
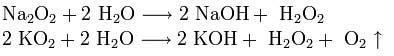
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
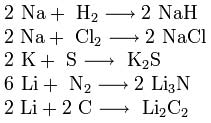
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
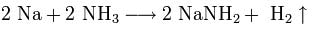
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:

Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
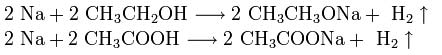
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
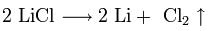
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
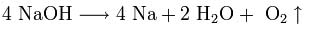
катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
