Мышьяк
| Мышьяк | |
|---|---|
| Атомный номер | 33 |
| Внешний вид простого вещества |
 |
| Свойства атома | |
|
Атомная масса (молярная масса) |
74,92159 а. е. м. (г/моль) |
| Радиус атома | 139 пм |
|
Энергия ионизации (первый электрон) |
946,2(9,81) кДж/моль (эВ) |
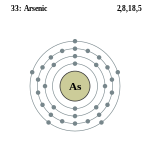
| Электронная конфигурация | [Ar] 3d10 4s2 4p3 |
| Химические свойства | |
| Ковалентный радиус | 120 пм |
| Радиус иона | (+5e)46 (-3e)222 пм |
|
Электроотрицательность (по Полингу) |
2,18 |
| Электродный потенциал | 0 |
| Степени окисления | 5, 3, −3 |
| Термодинамические свойства простого вещества | |
| Плотность | 5,73 (grey arsenic) г/см³ |
| Молярная теплоёмкость | 25,05 Дж/(K·моль) |
| Теплопроводность | (50,2) Вт/(м·K) |
| Температура плавления | 1090 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 876 K |
| Теплота испарения | 32,4 кДж/моль |
| Молярный объём | 13,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | a=4,132 α=54,13 Å |
| Отношение c/a | 2,805 |
| Температура Дебая | 285 K |
| As | 33 |
| 74,9216 | |
| 4s24p3 | |
| Мышьяк | |
Мышьяк — химический элемент с атомным номером 33 в периодической системе, обозначается символом As. Представляет собой хрупкий полуметалл стального цвета.
Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс. Греческое название arsenikon происходит от персидского زرنيخ (zarnik) — «жёлтый аурипигмент». Иногда его производят от греческого «арсен» — сильный, мощный.
Нахождение в природе
Мышьяк — рассеянный элемент. Содержание в земной коре 1,7·10-4% по массе. Это вещество может встречаться в самородном состоянии, имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из маленьких зернышек. Известно около 200 мышьяксодержащих минералов. В небольших концентрациях часто содержится в свинцовых, медных и серебряных рудах. Довольно часто встречаются два природных соединения мышьяка с серой: оранжево-красный прозрачный реальгар AsS и лимонно-желтый аурипигмент As2S3. Минерал, имеющий промышленное значение — арсенопирит (мышьяковый колчедан) FeAsS или FeS2•FeAs2, также добывают мышьяковистый колчедан — лёллингит (FeAs2).
Получение
Открытие способа получения так называемого металлического мышьяка (серого мышьяка) приписывают знаменитому средневековому алхимику Альберту Великому, жившему в XIII в. Однако гораздо ранее греческие и арабские алхимики умели получать мышьяк в свободном виде, нагревая «белый мышьяк» (то, что это триоксид мышьяка, а не простое вещество, было выявлено лишь в 1789 г. А. Л. Лавуазье, который и присвоил элементу название «арсеникум») с различными органическими веществами. Существует множество способов получения мышьяка: сублимацией природного мышьяка, способом термического разложения мышьякового колчедана, восстановлением мышьяковистого ангидрида и др.
Нагрев арсенопирит в муфельных печах
Для получения металлического мышьяка чаще всего нагревают арсенопирит в муфельных печах без доступа воздуха. При этом освобождается мышьяк, пары которого конденсируются и превращаются в твердый мышьяк в железных трубках, идущих от печей, и в особых керамиковых приемниках. Остаток в печах потом нагревают при доступе воздуха, и тогда мышьяк превращается в As2O3. Металлический мышьяк получается в довольно незначительных количествах, и главная часть мышьякосодержащих руд перерабатывается в белый мышьяк, то есть в триоксид мышьяка — мышьяковистый ангидрид As2О3.
Применение
Мышьяк используется для легирования сплавов свинца, идущих на приготовление дроби, так как при отливке дроби башенным способом капли сплава мышьяка со свинцом приобретают строго сферическую форму, и кроме того, прочность и твёрдость свинца возрастают. Мышьяк особой чистоты (99,9999 %) используется для синтеза ряда практически очень ценных и важных полупроводниковых материалов — арсенидов и сложных алмазоподобных полупроводников. Сульфидные соединения мышьяка — аурипигмент и реальгар — используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи.
В пиротехнике реальгар употребляется для получения «греческого», или «индийского», огня, возникающего при горении смеси реальгара с серой и селитрой (ярко-белое пламя). Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний, так как оказывают клинически значимое стимулирующее влияние на ряд функций организма, в частности, на кроветворение.
Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство (тот самый «мышьяк», который закладывают в канал зуба перед удалением нерва и пломбированием). В настоящее время препараты мышьяка применяются в зубоврачебной практике редко из-за токсичности и возможности проведения безболезненной денервации зуба под местной анестезией.
Биологическая роль и физиологическое действие
Мышьяк и все его соединения ядовиты. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло успешно использовать соединения мышьяка (чаще всего, триоксид мышьяка) в качестве смертельного яда. Во Франции порошок триоксида мышьяка за высокую «эффективность» получил обиходное название «наследственный порошок» (фр. poudre de succession). В 1832 появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность раскрытия отравлений.
Помощь и противоядия при отравлении мышьяком: приём водных растворов тиосульфата натрия Na2S2O3, промывание желудка, приём молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка 0,5мг/м³. Работают с мышьяком в герметичных боксах, используя защитную спецодежду. Из-за высокой токсичности соединения мышьяка использовались Германией как отравляющие вещества в Первую мировую войну. Существует предположение, что соединениями мышьяка был отравлен Наполеон на острове Святой Елены.
На территориях, где в почве и воде избыток мышьяка, он накапливается в щитовидной железе у людей и вызывает эндемический зоб.
Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк», например «Таблетки Бло с мышьяком», и др.) продолжалось до середины 1950-х гг., и внесло свой весомый вклад в развитие онкологических заболеваний.
Недавно широкую огласку получила техногенная экологическая катастрофа на юге Индии — из-за чрезмерного отбора воды из водоносных горизонтов мышьяк стал поступать в питьевую воду. Это вызвало токсическое и онкологическое поражение у десятков тысяч людей.
Считалось, что «микродозы мышьяка, вводимые с осторожностью в растущий организм, способствуют росту костей человека и животных в длину и толщину, в отдельных случаях рост костей может быть вызван микродозами мышьяка в период окончания роста».
Считалось также, что «При длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет: Этот факт установлен как для людей, так и для животных. Известны случаи, когда привычные потребители мышьяка принимали сразу дозы, в несколько раз превышающие смертельную, и оставались здоровыми. Опыты на животных показали своеобразие этой привычки. Оказалось, что животное, привыкшее к мышьяку при его употреблении, быстро погибает, если значительно меньшая доза вводится в кровь или под кожу.» Однако такое «привыкание» носит очень ограниченный характер, в отношении т. н. «острой токсичности», и не защищает от новообразований. Тем не менее, в настоящее время исследуется влияние микродоз мышьяксодержащих препаратов в качестве противоракового средства.
Загрязнения мышьяком
На территорииРоссийской Федерации в г. Скопин Рязанской области вследствие многолетней работы местного металлургического комбината СМК «Металлург» в могильниках предприятия было захоронено около полутора тысяч тонн пылеобразных отходов с 80 % содержанием мышьяка. С учётом того, что пяти миллиграммов мышьяка достаточно, чтобы отравить человека, в могильниках находится более 200 миллиардов смертельных доз мышьяка.
Соединения мышьяка
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | ---- | VIIIB | ---- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |